新闻网讯(通讯员赵珺)4月19日,武汉大学医学研究院、教育部免疫与代谢前沿科学中心、中南医院和泰康生命医学中心肖锐教授团队在Genome Biology在线发表了题为RBM22 regulates RNA polymerase II 5′ pausing, elongation rate, and termination by coordinating 7SKPTEFb complex and SPT5的论文。肖锐课题组的博士研究生杜贤、秦文英为共同第一作者,肖锐为通讯作者。

该研究发现了剪接因子RBM22的非剪接依赖性的转录调控功能,包括RBM22抑制Pol II在启动子近端的暂停释放以及双向转录;RBM22维持Pol II的快速延伸;RBM22促进蛋白编码基因和snoRNA/snRNA基因的转录终止。该研究成果揭示了剪接因子的功能多样性——“兼职”转录调控,对全面理解RNA结合蛋白的基因表达调控功能具有重要意义。
RBM22是一个地道的剪接因子,参与剪接体的组装。为解析RBM22介导的转录调控机制,该团队首先分析了RBM22与染色质互作的规律,发现互作不仅富集于基因启动子区域,还富集于基因主体区域和基因末端区域,这种结合模式近似延伸中的PolII(Ser2PPolII)的结合模式;采用互作蛋白质组分析联合功能基因组学分析发现,RBM22选择性结合启动子近端暂停的和延伸中的PolII以及抑制性的7SK-P-TEFb复合物,并通过稳定基因启动子区域结合的7SK-P-TEFb复合物来抑制P-TEFb从启动子到基因主体区域的易位,进而抑制Pol II在启动子近端的暂停释放。值得一提的是,本研究揭示了一种调控PolII启动子近端的暂停释放的新机制——染色质水平的P-TEFb易位驱动PolII暂停释放,与之前报道的直接招募活性P-TEFb来激活转录延伸的机制截然不同。此外,RBM22还通过维持延伸因子SPT5与PolII的互作,参与PolII启动子近端暂停、延伸动力学以及转录终止等方面的调控。
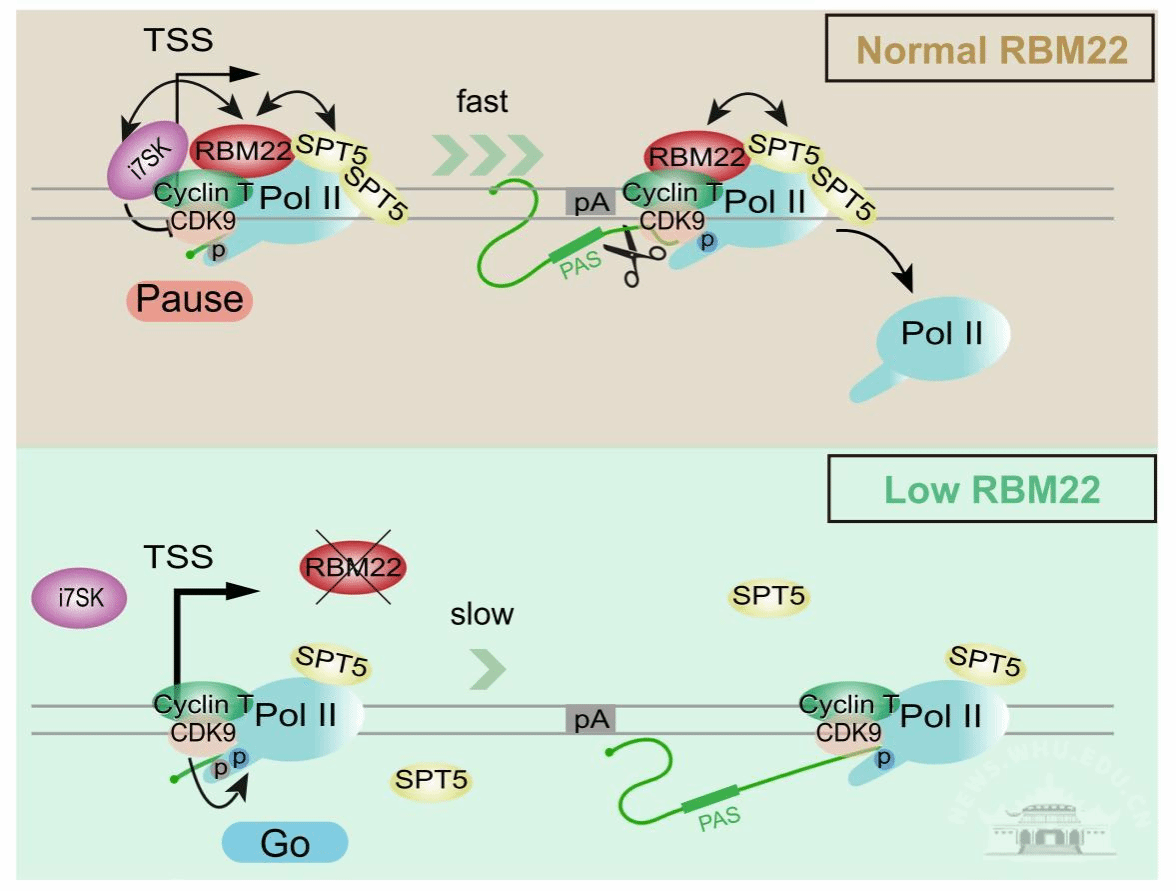
综上,这一最新研究揭示了剪接因子RBM22通过协调7SK-P-TEFb复合物在染色质水平的稳态以及延伸因子SPT5-PolII互作来介导“兼职”转录调控的功能,也提示RNA结合蛋白的“多才多艺”可能参与更多意想不到的生物学过程以及生理、病理过程。
据悉,该项工作得到武汉大学生命科学学院周宇教授、南京大学生命科学学院陈加余教授和湖北工业大学生命科学与健康学院唐景峰教授的大力支持;得到了国家重点研发计划项目、国家自然科学基金面上项目、国家高层次人才青年项目、武汉大学泰康生命医学中心经费以及武汉大学中南医院转化医学及交叉学科研究联合基金等资助。本研究还获得武汉大学医学研究院仪器设备共享中心和行政团队的大力支持。
原文链接:https://genomebiology.biomedcentral.com/articles/10.1186/s13059-024-03242-6
(文章来源:http://news.whu.edu.cn/info/1015/456737.htm)
